過去20年,中國醫療器械行業以“模仿式創新”打破海外壟斷,快速縮短與發達國家的差距。尤其是低值醫用耗材和中低端醫療設備領域,國產企業已在全球市場占據一定優勢。
如今,中國醫療器械市場已成為全球第二大市場,2025年市場規模將突破1萬億元。在這個規模超萬億元的市場,“模仿式創新”顯然不再能滿足需求。因此,中國醫療器械行業需要從“模仿式創新”轉向“基于臨床需求的原始創新”。
不過,對于投資人而言,“基于臨床需求的原始創新”通常具有高技術門檻和壁壘,且具有研發周期長、前期投入大、不確定性高、風險大等特點。但是,“基于臨床需求的原始創新”卻有望顛覆原有市場格局,帶來新一輪產業革命。
一邊是巨大風險,一邊是巨大收益。對此,越來越多的投資人選擇拿出真金白銀“投早、投小”,以推動科技創新、加速產業變革。目前,這些投資人手握大把鈔票,正在尋找下一個醫療器械顛覆性創新技術。
動脈網通過與數位投資人溝通交流,并根據以往投融資數據及創新技術的發展階段,找到了5個創新性強、商業化潛力大、有望顛覆現有市場的創新技術,供大家參考。
一、介入式人工心臟(pVAD)
介入式人工心臟(pVAD),即經皮置入心室輔助裝置,是將小型血泵經皮以介入方式置入心室,通過血泵的作用引流血液進入動脈系統,實現部分或全部替代心臟泵血功能,起到維持人體血液循環的作用。
介入式人工心臟可應用于急性心肌梗死救治、高危PCI手術防護等臨床場景,有助于提高相關適應癥的搶救存活率。其中,急性心肌梗死救治、PCI等手術,我國每年開展超百萬例,市場空間巨大。
在海外,Abiomed已驗證了介入式人工心臟的臨床價值及商業價值。從臨床上看,Abiomed推出的介入式人工心臟產品Impella系列已在全球應用,并已被多個臨床指南推薦應用。不過,該產品的滲透率仍處較低水平,還有極大發展空間。
從商業上看,2022財年,Abiomed營收10.3億美元,同比增長22%,其中來自介入式人工心臟產品的收入為9.85億美元,占比超95%。可以說,Abiomed靠介入式人工心臟產品撐起了166億美元估值(約合人民幣1150億)。2022年11月,強生宣布以166億美元收購Abiomed,同時,若未來達成既定商業和臨床試驗里程碑,Abiomed的股東還將額外獲得最高每股35美元現金權益。
全球范圍內,目前僅Abiomed的Impella系列獲FDA批準,國內則尚無任何一款介入式人工心臟產品獲批。不過,國內已有通靈仿生、心嶺邁德、心擎醫療、迪遠醫療、豐凱利醫療、心恒睿醫療、核心醫療等企業布局,還有紅杉中國、君聯資本、鼎暉VGC、千驥資本、雅惠投資、泰福資本、元生創投、辰德資本、禮來亞洲基金、正心谷資本等知名投資機構押注。
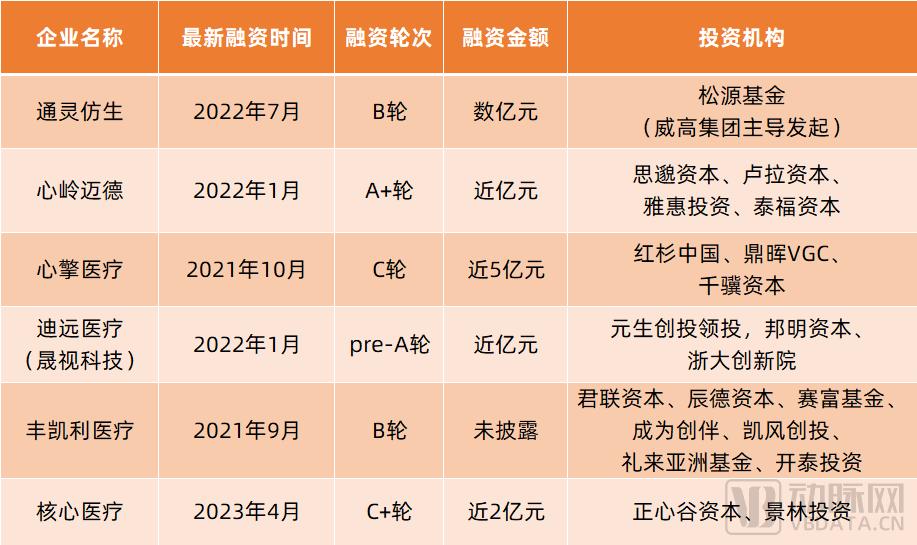
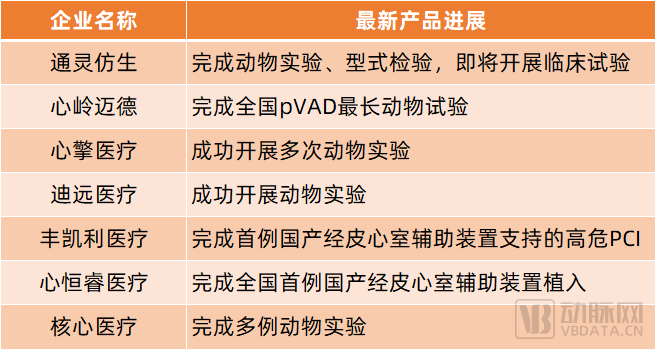
其中,通靈仿生已完成動物實驗、型式檢驗,即將進入臨床試驗;心嶺邁德、心擎醫療、迪遠醫療、核心醫療均已開展動物實驗;豐凱利醫療自主研發的的SynFlow?3.0已于2023年1月進入NMPA創新醫療器械特別審查程序。
根據公開信息整理
二、組織工程小口徑人工血管
當人體血管由于疾病、創傷等因素不能正常運輸血液時,人工血管可置換血管或旁路搭橋,使血液能夠正常運輸。目前,人工血管被廣泛應用于主動脈置換或搭橋、外周血管旁路移植術、血管創傷修復、血液透析血管通路、冠脈旁路移植術等多種臨床場景。
根據《全球及中國人造血管行業研究及十四五規劃分析報告》,2020年全球人工血管市場規模達到235億元,預計2027年將達到318億元。
按照口徑大小,人工血管被分為大、中、小三種規格,通常稱10毫米以上的為大口徑人工血管,介于6毫米和10毫米之間的為中等口徑,小于6毫米的是小口徑。其中,如今臨床上應用的主要為大、中口徑人工血管,全球仍未有小口徑人工血管獲批。
與此相對的是,小口徑動脈疾病具有較高的發病率和死亡率。若開發出小口徑人工血管,不僅能救治更多血管病患者,還可極大開拓人工血管市場,并取得豐厚商業回報。
據介紹,大、中口徑人工血管主要以滌綸和膨體聚四氟乙烯為主要材料。此種材料制造小口徑人工血管時存在血栓、內膜增生、感染等問題,臨床表現不佳。不過,隨著材料科學的突破及組織工程技術的發展,已有多家創新企業研發布局小口徑人工血管,并已取得優異臨床數據。
業內人士認為:隨著依靠新材料、新技術的人工血管公司崛起,傳統的不可吸收高分子人工血管將退出歷史舞臺。
例如,人工血管領先企業Humacyte研發的人類脫細胞組織工程血管(HAV),采用組織工程技術,在人體外生成“活”的人體血管,臨床表現優異。截至2021年底,HAV已植入約471名患者體內,迄今為止沒有免疫排斥反應。Humacyte估計,若HAV產品最終獲得FDA批準,其血管產品的潛在峰值銷售額每年將達到121億美元。
值得一提的是,2018年,費森尤斯就與Humacyte的HAV技術商業化權利簽署了1.5億美元的戰略合作協議。
在國內,領博生物、柔脈醫療、武漢楊森、海邁醫療等創新企業也已依托組織工程等技術布局小口徑人工血管。
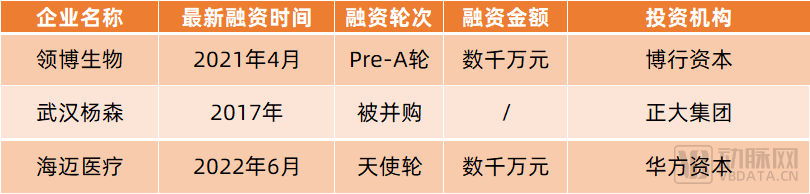
其中,領博生物自主研發的生物型人工血管已于2022年8月完成首例臨床入組;柔脈醫療已研發出小口徑組織工程化人工血管與組織化電子血管;武漢楊森研發的小口徑人工血管已獲批進入綠色通道,并進入動物實驗階段;海邁醫療研發出了自體和同種異體脫細胞基質小口徑人工血管。

根據公開信息整理
三、高分子瓣膜
高分子瓣膜是一種基于新材料和新技術、能夠更好治療心臟瓣膜病的創新器械。
《中國心血管健康與疾病報告2021》顯示,中國約有2500萬例瓣膜性心臟病患者,在中國65歲以上人群中,心臟瓣膜疾病越來越普遍。預計隨著人口老齡化趨勢的增加,瓣膜疾病的發病率將逐年上升。
從臨床上看,心臟有二尖瓣、三尖瓣、主動脈瓣和肺動脈瓣四個瓣膜。其中,預計2030年二尖瓣介入治療市場規模將達1200億元;主動脈瓣介入治療市場規模將達1100億元……市場空間極為廣闊。
在治療上,針對嚴重瓣膜性心臟病患者,更換人工心臟瓣膜是最有效的治療手段。據介紹,目前臨床上常用的人工心臟瓣膜依據材料可分為機械瓣(以熱解碳制作)和生物瓣(以豬、牛等來源的生物組織制作)。
機械瓣的優勢是使用時間長,設計使用壽命超過50年,但熱解碳材料的血液相容性差,易引發血栓栓塞等并發癥,且患者術后必須終生服用抗凝藥物,極大影響患者的生活質量。
生物瓣的優勢則是以生物組織制作,具有較好的血液相容性,只需在術后3-6個月服用抗凝藥。不過,生物瓣的使用壽命僅有10-15年,難以滿足目前越來越年輕的瓣膜病患者的需求,甚至部分患者在瓣膜置換不久后就出現瓣膜組織鈣化,并引起瓣膜衰敗。
隨著材料科學的突破,有創新企業研發出融合了機械瓣及生物瓣雙重優勢的高分子瓣膜。與傳統機械瓣和生物瓣相比,高分子瓣膜具有優異的耐疲勞性,使用壽命長,且具有極好的血液相容性,患者無需長期服用抗凝藥。
例如,全球高分子瓣膜領域先驅企業Foldax推出的高分子瓣膜產品已進入人體臨床試驗階段。現有臨床數據表明:Foldax的高分子瓣膜產品比傳統生物瓣膜的使用壽命更長,長達25年;高分子瓣膜植入一年后,患者的跨瓣壓差、瓣膜有效開口面積(EOA)和心功能均得到了明顯改善,且患者無需長期服用抗凝藥。
目前,全球范圍內僅有少數企業掌握高分子瓣膜技術。其中,國內有心嶺邁德、心銳醫療、以心醫療等企業布局。
截止目前,心嶺邁德已完成首例國產高分子外科瓣膜動物實驗;心銳醫療同步研發了高分子外科主動脈瓣、二尖瓣以及介入主動脈瓣;以心醫療自主研發的高分子經股主動脈瓣置換系統已于2022年7月完成首例臨床。

根據公開信息整理
四、脈沖電場消融技術
脈沖電場消融技術是一種基于不可逆電穿孔效應的創新消融方式,目前正被探索性應用于房顫消融,被稱為PFA(脈沖電場消融系統)。其中,不可逆電穿孔是指在一定的電場強度下,細胞膜永久通透,細胞內容物泄露,致使細胞凋亡。
研究表明:脈沖電場消融技術具有組織選擇性。例如,在針對心肌細胞的特定電場參數下,心肌細胞會發生不可逆電穿孔,而內皮細胞、神經細胞、平滑肌等不受影響。
目前,關于房顫的消融治療主要以射頻消融與冷凍消融為主。射頻消融技術是通過射頻電流使病變組織產生熱效應,消融心肌細胞,從而治療房顫;冷凍消融技術是通過制冷劑的蒸發吸熱效應,使病變部位溫度驟然降低,并使病變區域細胞受損或死亡,從而治療房顫。
與射頻消融及冷凍消融治療房顫的原理一致,脈沖電場消融也是通過“殺死”對應的病變細胞,從而恢復心房正常有序的電活動。
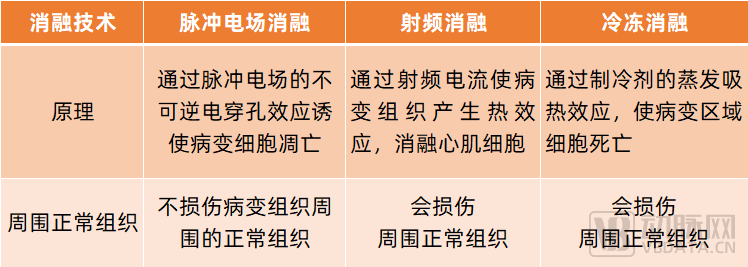
不過,射頻消融與冷凍消融利用溫度效應消融細胞,易造成病變部位周圍正常組織受損,引發并發癥。而脈沖電場消融技術基于組織選擇性,可有選擇性地殺傷心肌組織,確保膈神經、神經、冠脈等其他正常組織的安全,從而提高治療效果,降低術后并發癥。
事實上,脈沖電場消融技術還可應用于多種臨床場景,如腫瘤消融。相比于腫瘤消融中常見的射頻消融和冷凍消融方式,脈沖電場消融可選擇性消融腫瘤組織,保存治療區內的動脈、膽管、神經束、支氣管等重要結構,并可治療其他設備無法消融的腫瘤,如血管、神經周圍的腫瘤。
從市場看,我國心臟電生理市場規模預計到2023年將達到123.2億元,腫瘤消融行業市場規模預計到2023年將達到61.5億元。而脈沖電場消融技術較射頻消融、冷凍消融具有原理性優勢,有望成為未來的主流消融技術。
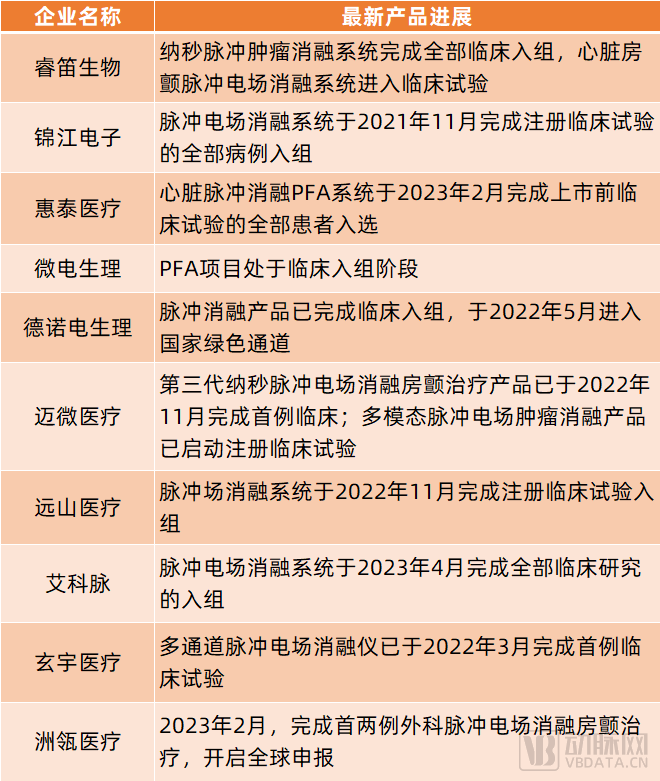
或許也是因此,波科、強生、美敦力等跨國械企均已開始布局相關產品管線。在國內,惠泰醫療、捍宇醫療、微電生理、錦江電子、睿笛生物、德諾電生理、玄宇醫療、艾科脈、洲瓴醫療、睿刀醫療、邁微醫療、遠山醫療等企業也已有所布局,且進展極快。
其中,睿笛生物的納秒脈沖腫瘤消融系統已完成全部臨床入組,心臟房顫脈沖電場消融系統已進入臨床試驗;錦江電子的脈沖電場消融系統于2021年11月完成注冊臨床試驗的全部病例入組;惠泰醫療的心臟脈沖消融PFA系統于2023年2月完成上市前臨床試驗的全部患者入選……總的來看,預計國產脈沖電場消融系統將快速陸續獲批。
根據公開信息整理
五、血管內沖擊波技術
血管內沖擊波技術是美國上市公司Shockwave受超聲波碎石技術啟發而創新出的一種適用于血管內鈣化的新技術。同時,Shockwave還基于血管內沖擊波技術研發出了用于冠脈及外周血管鈣化的沖擊波球囊。
目前,Shockwave市值約為106億美元(約合人民幣735億元)。5月11日,有媒體報道:強生及美敦力考慮聯手收購醫療公司Shockwave。此前,有媒體于4月曝出波士頓科學正探索收購Shockwave。無論消息真假,可見市場對血管內沖擊波技術的關注度極高。
而血管內沖擊波技術針對的中重度血管鈣化也行業長期存在的難題,其不僅有可能導致血管成形術失敗,還會增大手術風險、增加手術即刻并發癥及支架內血栓的發生率。另一方面,血管鈣化是動脈粥樣硬化、高血壓、糖尿病血管病變、血管損傷、慢性腎病等普遍存在的共同病理表現,具有發病率高、危害大的特點。
基于龐大患者數及嚴重疾病危害,沖擊波球囊或將成為血管鈣化患者的剛需。
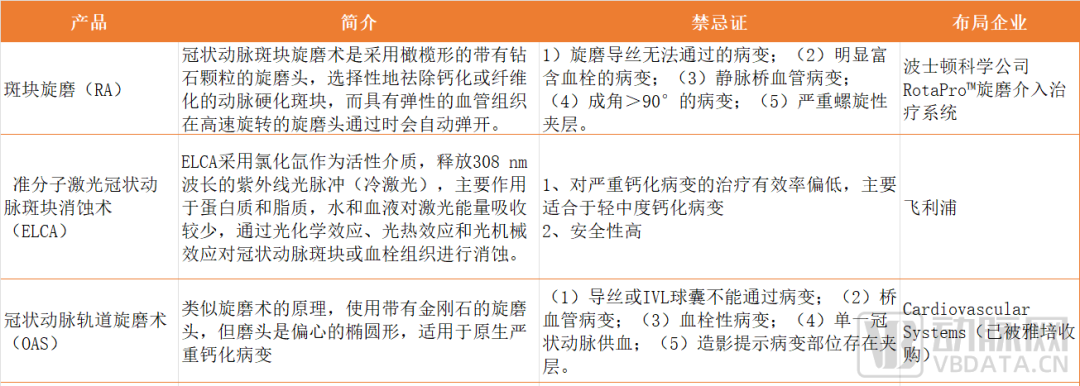
此前,市場上也有多種解決方案,如斑塊旋磨術(RA)、準分子激光冠脈斑塊消蝕術(ELCA)、冠脈軌道旋磨術(OAS)。但是,此類治療方式均有一定局限性。
相比于傳統治療方案,沖擊波球囊在植入病變血管段后,可釋放脈沖聲壓波,將鈣化斑塊“震松”,最終輕松植入支架等治療器械,使患者血流重建、心臟功能恢復正常。
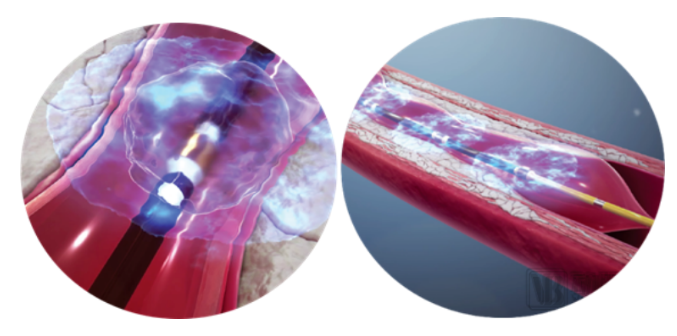
Shockwave的產品作用于血管示意圖
在治療效果上,Shockwave發布的臨床試驗數據顯示,沖擊波球囊在血管鈣化病變的治療中,安全性高、心血管主要不良事件發生率低,無穿孔、遠端栓塞、急性閉塞等嚴重并發癥;有效性好,手術成功率高、術后管腔即刻獲得高、管腔殘余狹窄率低、支架擴張良好。
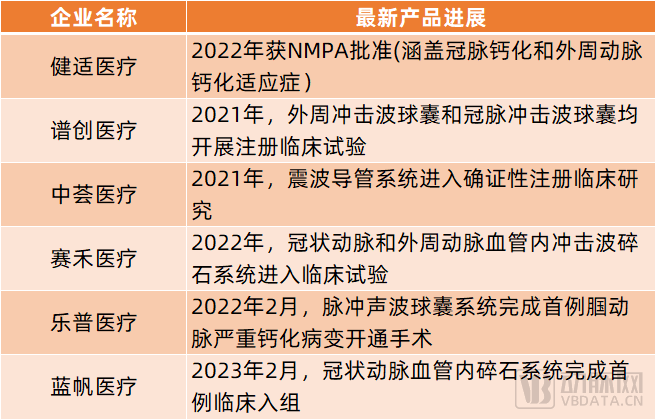
如今,健適醫療與Shockwave合作,已將其沖擊波球囊引進國內,并于2022年獲NMPA批準。除了健適醫療,國內還有譜創醫療、中薈醫療(匯禾醫療子公司)、賽禾醫療、樂普醫療、藍帆醫療、北芯醫療等多家企業布局血管內沖擊波技術。
其中,譜創醫療自主研發的外周沖擊波球囊和冠脈沖擊波球囊均已于2021年開展注冊臨床試驗;中薈醫療研發的震波導管系統已于2021年進入確證性注冊臨床研究;賽禾醫療研發的冠狀動脈和外周動脈血管內沖擊波碎石系統已于2022年進入臨床試驗;樂普醫療研發的脈沖聲波球囊系統已于2022年2月完成首例腘動脈嚴重鈣化病變開通手術;藍帆醫療旗下的冠狀動脈血管內碎石系統已于2023年2月完成首例臨床入組……
根據公開信息整理
除此外,沛嘉醫療還研發出沖擊波瓣膜治療系統,將血管內沖擊波技術拓展應用于心臟瓣膜鈣化性狹窄的治療。目前,沛嘉醫療的沖擊波瓣膜治療系統已完成多例手術,均展現出良好的安全性及治療效果。



